Cas9 nuclease, Base editor, Prime editor 등을 포함한 CRISPR/Cas 기반 유전자 편집시스템은 표적 유전자와 상보적인 guide RNA의 서열을 통해 편집할 위치가 특정됩니다.
마우스와 인간에게 공통으로 존재하는 유전자라 할지라도 종에 따라 일부 아미노산 서열이 다를 수 있으며, 아미노산 서열이 동일함에도 경우에 따라서는 다른 codon으로 구성되어 있을 수 있습니다.
때문에 일반적인 마우스 모델을 이용할 경우 동물실험을 위한 sgRNA와 실제 환자에게 적용하고자 하는 sgRNA의 셔얼이 일치하지 않을 가능성이 존재합니다.
따라서 편집을 하고자 하는 유전자에서 sgRNA가 결합해야 하는 마우스 DNA의 일부 서열을 인간의 유전자 서열로 치환하는 것이 필요할 수 있습니다.
이때 DNA 서열 치환으로 인해 발생하는 아미노산의 변경 또는 synonymous mutation이 마우스에서 의도하지 않은 질환을 유도하지는 않는지 면밀한 검토가 필요합니다.
1. 사람과 마우스의 PDE6B 유전자를 구성하는 아미노산 서열의 차이
7%의 아미노산 서열 차이가 존재
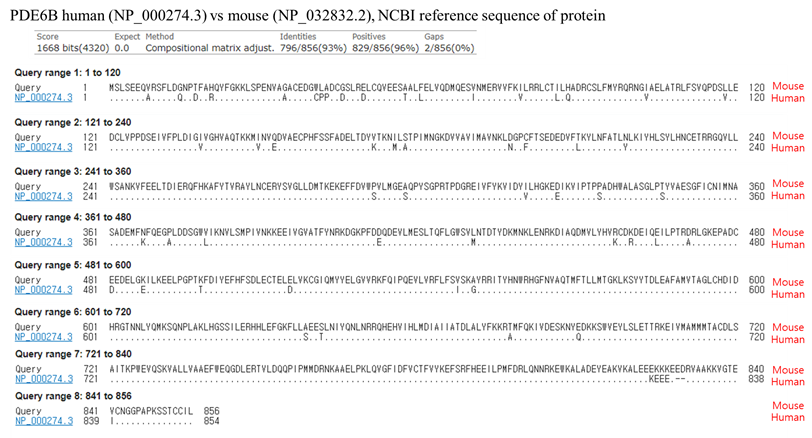
(그림출처) 서울대학교 수의과대학 김경미교수님 연구실 제공
2. 사람과 마우스의 PDE6B 유전자 exon 13의 DNA 염기서열의 차이
아미노산이 대부분 일치함에도 불구하고 15%의 염기서열 차이가 존재
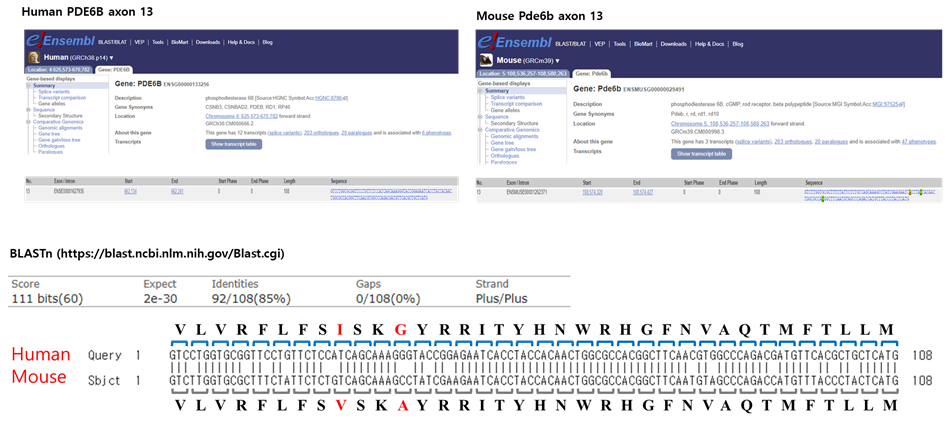
(그림출처) 서울대학교 수의과대학 김경미교수님 연구실 제공
마우스 제작은 CRISPR/Cas9 및 Donor template를 이용한 HDR 유도를 통해 이루어집니다.
1) sgRNA 디자인
- 인간의 유전자 서열로 치환하고자 하는 마우스의 유전자 위치와 상보적으로 결합할 수 있는 sgRNA를 준비합니다.
- 필요에 따라서 치환하고자 하는 위치의 양 끝을 자를 수 있도록 두개의 sgRNA를 준비합니다.
- sgRNA는 off-targe이 최대한 발생하지 않을 위치를 고려해서 디자인 합니다.
- sgRNA design 시 온라인 프로그램을 활용하여 디자인할 수 있습니다. (http://www.rgenome.net/)
- 마우스 배아에 적용하는 경우 안전성을 위해서 In vitro transcription을 통해 sgRNA를 제작합니다.
- In vitro cleavage assay를 통해 sgRNA의 활성을 확인한 후 마우스 배아실험에 적용합니다.
2) Donor template 디자인
- Donor template는 ssODN, AAV 등 다양한 형태의 DNA template로 구성할 수 있습니다.
- 삽입하고자 하는 인간의 유전자 서열 양 끝에 남길 마우스의 원래 유전자 서열을 삽입하여 homology arm을 구성합니다.
- 치환하고자 하는 유전자가 exon의 시작 또는 끝 부분인 경우 splicing에 유의해서 intron 위치를 포함해야 할 수 있습니다.
3) 마우스 수정란 편집
(1) Microinjcetion 방법
- 전핵이 2개 보이는 수정란의 두 핵 중 하나에 Donor, sgRNA, Cas9 protein의 mixture를 microinjection 합니다.
- in-vitro에서 하루 배양하면서 2 cell 단계로 진행한 수정란을 선별하여 대리모에 이식합니다.
(2) CRIPSR-VIM 방법
- 채취한 배아를 in-vitro에서 sgRNA와 Cas9 protein이 결합한 RNP(Ribonucleoprotein)를 포함하고 있는 바이러스유사입자(Virus-like particle, VLP) 및 Donor가 포함된 배지에서 하루 배양합니다.
- 다음 날 2 cell 단계로 진행된 수정란을 선별하여 대리모에 이식합니다.
(3) Electroporation 방법
- 채취한 배아를 sgRNA와 Cas9 단백질로 구성된 리보핵단백질(RNP) 복합체 및 Donor DNA가 포함된 배지에 배양한 뒤, 전기장을 가하여 RNP와 Donor가 수정란 내부로 전달되도록 합니다.
- in-vitro에서 하루 배양하면서 2 cell 단계로 진행한 수정란을 선별하여 대리모에 이식합니다.