어류의 배아 단계에서 화학 물질의 급성 독성을 확인하기 위해 고안된 OECD Test Guideline No. 236 "Fish Embryo Acute Toxicity (FET) Test" 를 따르며 실험 목적에 따라 시험법을 변형하여 사용합니다.
제브라피쉬 배아의 화학물질 급성 독성 시험을 위하여 96시간 동안 테스트 화학물질에 노출하며, 매 24시간 동안 치사율의 지표로 최대 4개의 정점 관찰기록을 통하여 물고기의 50%를 죽이는 농도(LC50)를 결정합니다.
[관찰지표]
1. Coagulation of fertilized eggs
2. Lack of somite formation
3. Lack of detachment of the tail-bud from the yolk sac
4. Lack of heartbeat
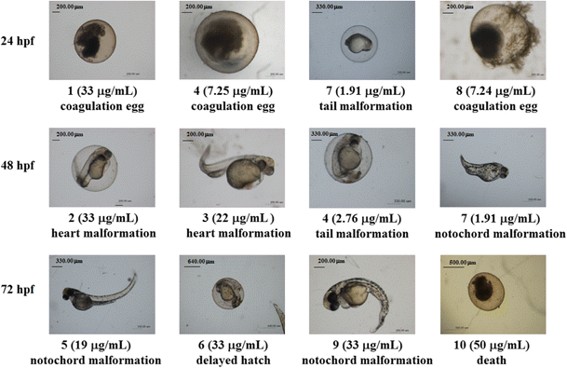
그림 1. 제브라피쉬 배아 급성 독성 시험에 사용되는 관찰지표 대표 표현형
* 그림출처: Bai H et al. Mar Biotechnol (NY). 2016;18(2):264-270.
[실험방법]
1. 실험 준비물
1) 테스트 물질
2) 양성 대조물질 : 3,4-dichloroaniline (3,4-DCA)
3) 유기용매 대조군 (유기용매 사용 시)
4) 시험용기: 96-well plate
5) Media
2. 배아준비
1) 시험 전날 저녁, 성체 제브라피쉬를 mating tank에 암수가 분리되게 준비한다.
2) 시험 당일 아침, 암수 분리막을 제거하여 제브라피쉬의 mating을 시작한다.
3) 교배 시작 3시간 후 산란알을 수거한다.
4) 수거한 산란알에서 발생 시기가 동일한 수정란을 선별하여 준비한다.
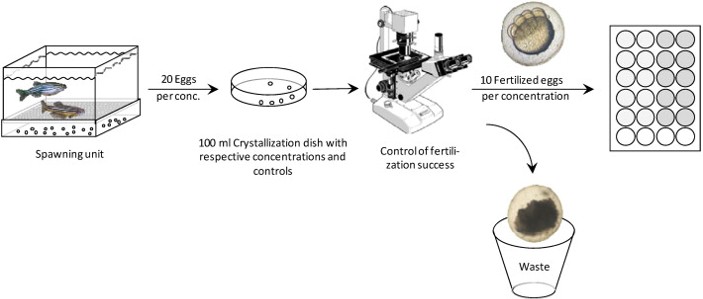
그림 2. 제브라피쉬 배아 급성 독성 시험
* 그림출처: Lammer E et al. Comp Biochem Physiol C Toxicol Pharmacol. 2009;149(2):196-209.
3. 시료 준비
1) 시료준비는 2-2)를 수행하고 바로 시작한다.
2) 양성 대조물질은 4 mg/L 3,4-dichloroaniline으로 준비한다.
3) 테스트 물질의 stock solution 농도는 100-1000X로 준비한다.
4) Working solution은 stock solution을 희석하여 1X, 0.46X, 0.22X, 0.1X, 0.046X, 0.022X, 0.01X 7가지 농도로 준비한다. (약물별로 농도가 다르니 그에 맞는 농도로 준비할 것.)
5) 유기용매를 사용할 경우, 유기용매 대조군을 준비하며 최대 농도는 0.1%를 넘지 않도록 한다.
6) 준비한 시료(대조군, 양성 대조군, 용매 대조군, 테스트군)는 96-well plate에 분주하여 incubator (26±1 ℃)에서 준비한다.
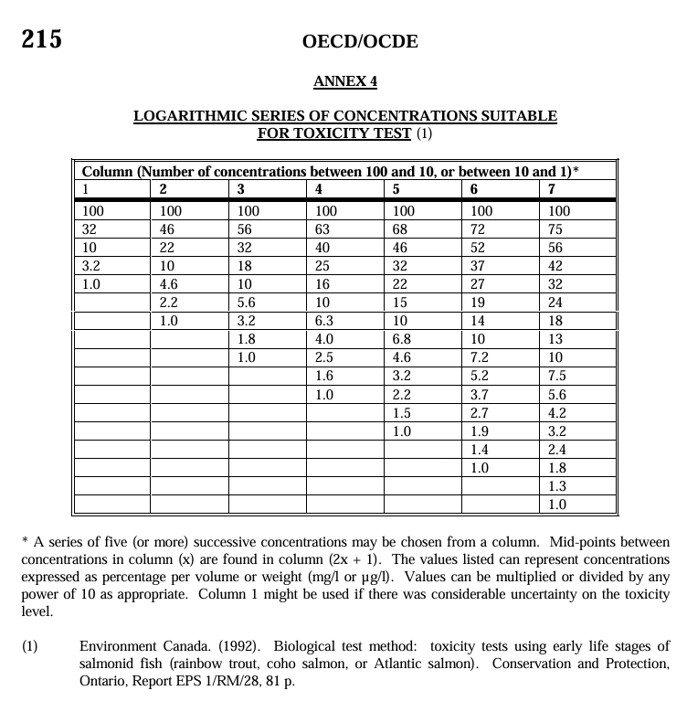
그림 3. 독성시험에 적합한 로그식 농도(출처: OECD Guideline No. 215)
4. 본시험
1) 3-6)에서 준비한 96-well plate에 2-4) 에서 준비한 수정란을 각 well 당 한 개체씩 노출되도록 옮긴다. 이때, 약물처리 시작 시간은 수정 후 4시간을 초과하지 않도록 주의한다.
2) 분주를 완료한 plate는 parafilm으로 sealing 한 후, 수정 후 120시간까지 incubator(26±1 ℃)에서 배양한다.
5. 관찰
1) 24시간마다 well plate를 꺼내어 독성 영향을 확인한다. 시간별 관찰사항은 엑셀 파일에 작성한다.
2) 살아남은 개체의 수는 mortality part에 기입하고 malformation이 일어난 경우, 그 수를 기입한다.
3) 대조군에 비해 발달이 많이 늦어질 경우에는 발생이 지연된 개체의 수를 기입한다. (Developmental delay의 경우, 발달단계 전후 4시간까지 정상범위로 간주한다.)
6. 시험의 유효성 기준
1) 산란알의 수정률은 70% 이상이어야 한다.
2) 시험기간 동안 온도는 26±1 ℃로 유지되어야 한다.
3) 대조군(및 용매 대조군)에서 배아의 생존율은 90% 이상이어야 한다.
4) 120시간 관찰 시, 양성 대조군(3,4-dichloroaniline)은 최소 30%의 치사를 나타내야 한다.
5) 대조군의 부화율이 80% 이상이어야 한다.