성체 제브라피쉬에서 혈액을 채취할 수 있습니다. 일반적으로 실험을 위해 소량의 제브라피쉬의 혈액을 채취할 때 다음과 같은 방법을 사용합니다. 가장 일반적인 방법은 물고기를 마취시킨 후, 꼬리 지느러미에서 가까운 동맥 또는 정맥을 통해 주사바늘을 사용하여 혈액을 채취하는 것입니다. 이러한 방법은 마취제로 Tricaine을 사용하여 살아있는 동물의 스트레스를 최소로 해주어야 합니다.
두번째 방법은 제브라피쉬 성체를 마취 후 심장 천자(Puncture)를 통해 이루어지는데, 이는 첫번째 실험 방법에 비해 더 많은 양의 혈액이 필요할 때 사용됩니다. 이 실험 방법은 연구의 마지막 단계에서 수행되며 가능한 동물 고통을 최소화해야 합니다.
별도로 제브라피쉬 성체의 전체적인 혈액 분포를 확인하기 위해서는 제브라피쉬의 신장기관(Kidney Marrow)을 적출하여 진행합니다. 제브라피쉬에서는 조혈줄기세포를 포함한 혈액세포들이 대부분 신장에 분포하는데, 이는 인간과 포유류의 골수와 같은 역할을 합니다. 성체 제브라피쉬를 마취한 후, 배면을 절제하여 내부 기관을 제거하고 포셉을 이용하여 적출합니다. 이 과정에서도 마취제의 사용이 필요하며 마취제를 통해 안락사 단계를 진행시킨 후 실험을 진행하게 됩니다.
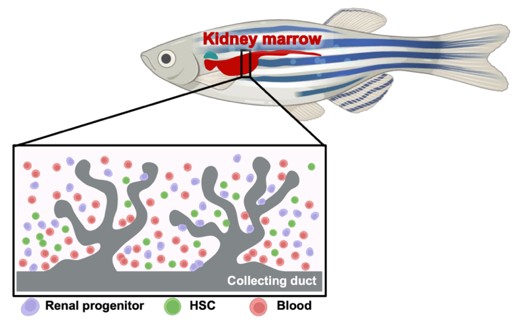
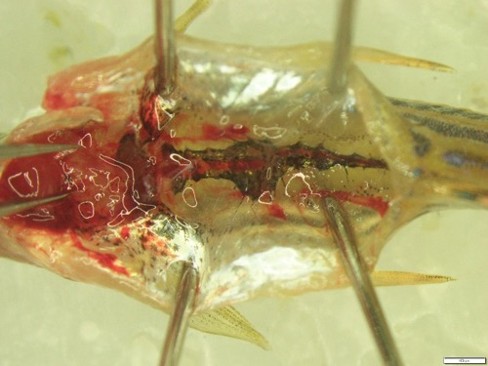
* 그림출처: Song H et al. Exp Mol Med. 2024;56(1):51-58.
적출된 신장기관은 피펫팅을 통해 분리할 수 있습니다. 분리된 혈액세포는 FACS(Fluorescence-Activated Cell Sorting) 분석을 통해 크기와 granulocyte의 분포에 따라 적혈구와 골수세포, 그리고 림프구와 혈구 전구세포로 나누어 분리할 수 있습니다. 이러한 FACS 분석은 제브라피쉬 성체에서의 혈액세포의 항상성이나 혈액질환 모델 연구에 활발히 이용됩니다.
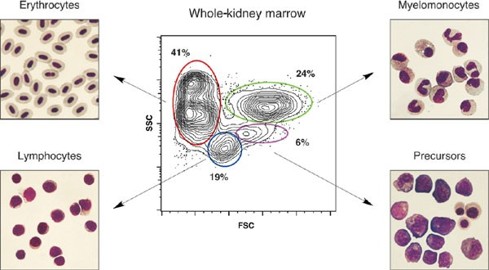
* 그림출처: Traver D et al. Nat Immunol. 2003;4(12):1238-1246.