[Retro-orbital Injection의 유용성]
Adult 및 neonatal mouse에서 어려운 미정맥 주사 대신 쉽고 빠르게 재현 가능한 투여 방법입니다. 또한 미정맥 주사보다 스트레스가 덜 할 수 있습니다.
[Adult Mouse에 대한 Retro-orbital Injection 방법]
1. 27.5G(Gauge) 이하, 0.5cm 바늘 길이의 인슐린 주사기 또는 27G이하, 0.5cm 바늘 길이의 Tuberculin 주사기를 준비합니다.
2. 오른손잡이로 예를 들면 마우스를 마취 후 좌측 측와위로 눕히고 눈의 등쪽과 배쪽 피부에 가벼운 압력을 가하여 마우스의 안구를 돌출 시킵니다. 이 때 호흡에 방해되도록 강하게 압박하지는 않습니다 (그림 1).
3. 진통을 위하여 0.5% proparacaine을 점안하고 바늘을 30°의 각도로 바늘사면을 아래로 향하게 하여 내안각(Medial Canthus)쪽으로 삽입합니다 (그림 2).
4. 안구 가장자리를 따라 아래로 진행하여 눈의 바닥에 도달할 때까지 진행합니다. 주사 전 흡인하지 않고 부드럽게 투여합니다.
5. 부드럽고 천천히 바늘을 뺍니다. 이 때 출혈이 거의 없거나 전혀 없어야 합니다.
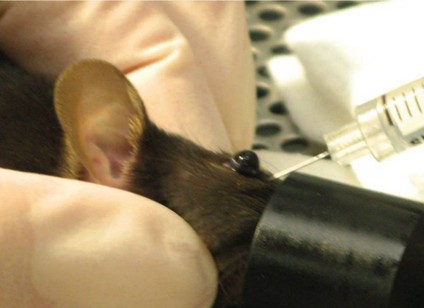
그림 1. Retro-orbital Injection 투여 예시
* 그림출처: Yardeni T et al. Lab Anim (NY). 2011;40(5):155-160.
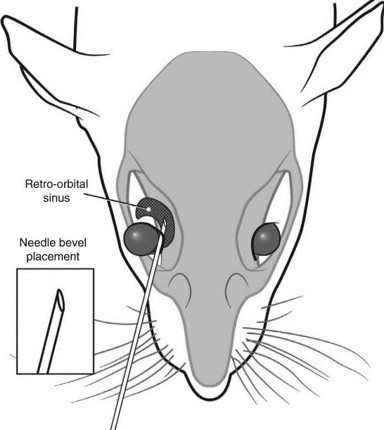
그림 2. Retro-orbital Injection 투여 모식도
* 그림출처: Yardeni T et al. Lab Anim (NY). 2011;40(5):155-160.
[Neonatal Mouse에 대한 Retro-orbital Injection 방법]
1. 생후 1-2일령 마우스에 이 투여 방법을 사용할 수 있습니다.
2. 보온 장치와 부드러운 거즈가 포함된 nesting이 있는 작은 용기에 neonatal mouse를 넣고 거즈 패드를 덮어 더 따뜻하게 해 줍니다.
3. 31G, 0.3125 inch 바늘길이의 0.3ml 인슐린 주사기를 사용합니다.
4. 마취는 하지 않고, 해부현미경(8-10배 확대면 충분)을 사용합니다.
5. Adult mouse와 마찬가지로 오른손잡이라면 neonatal mouse를 좌측 측와위로 눕히고 엄지와 검지손가락 끝으로 머리를 고정합니다. 호흡을 방해하지 않도록 너무 강하게 압박하지 않습니다. Neonatal mouse의 나머지 몸은 엄지와 검지손가락사이에 자리잡습니다 (그림 3).
6. 멸균식염수와 면봉을 사용하여 눈위를 부드럽게 닦고(너무 적시면 저체온증의 위험이 있음) 바늘 사면을 아래로 향하게 하여 3시 위치에서 내안각(Medial Canthus)이 될 부위인 eye socket에 약 30°의 각도로 삽입합니다 (그림 3).
7. 부드럽게 투여를 하고 천천히 바늘을 빼내고 neonatal mouse를 보온이 되는 다른 용기에 놓습니다.
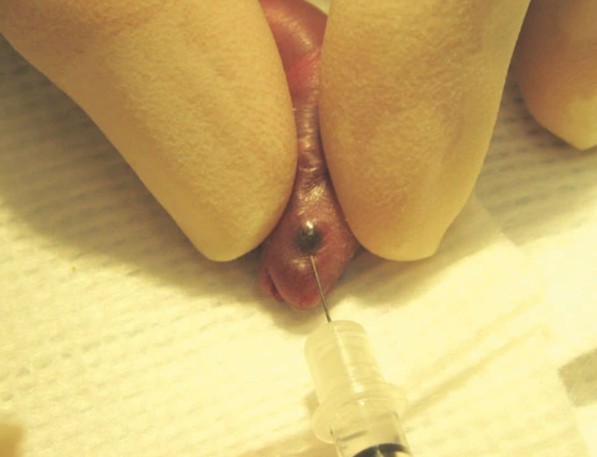
그림 3. Neonatal mouse에 대한 Retro-orbital Injection 투여 예시
* 그림출처: Yardeni T et al. Lab Anim (NY). 2011;40(5):155-160.