[Tail Vein Injection이란?]
Tail Vein Injection(미정맥 주사)은 mouse에서 정맥 주사 시 가장 널리 사용되는 방법입니다. 꼬리의 왼쪽, 오른쪽에 있는 측면 꼬리 정맥을 사용해야 하고, 배측 꼬리 동맥보다 접근이 어려운 등쪽 꼬리 동맥에는 투여하지 않습니다 (그림 1). 마취없이 보정장치 내에서도 투여가 가능한 방법입니다.
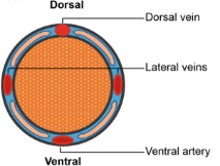
그림 1. 마우스 꼬리 혈관 모식도: Liu P et al. Methods Mol Biol. 2021;2279:199-212.
[방법]
1. 투여용량은 총 혈액량의 10%를 초과할 수 없습니다 (마우스의 총 혈액량: 72ml/kg).
2. 투여용액은 멸균상태여야 하고, 투여 전 실온으로 따뜻하게 합니다.
3. 무균적으로 주사기에 용액을 채우고 동물 체중을 측정 한 후 고정 장치로 옮깁니다.
4. 열램프를 꼬리에 조사하거나 따뜻한 물에 20-30초 동안 담군 후 혈관확장을 유도합니다. 이 때 조직 손상을 줄 수 있는 과열 및 화상에 주의합니다.
5. 주사기에 투여용액을 채우고 공기층이 없도록 준비합니다. 동물 당 주사기와 바늘을 하나씩 사용합니다. 바늘은 날카로워야 하며 2번 시도한 후 교체해야 합니다.
6. 꼬리 끝을 살짝 들어올리고 부드럽게 돌려서 측면 꼬리 정맥을 찾고 70% 알코올로 닦습니다.
7. 주로 사용하지 않는 손(Non-dominant Hand)의 검지와 중지를 주사부위 윗부분의 꼬리 주위를 잡고, 주사부위 아래부분에는 엄지와 약지 사이로 잡습니다. 손가락에 약간의 압력과 긴장을 주어 팽팽하게 당깁니다 (그림 2).
8. 꼬리 뒤쪽 1/3지점에서 바늘의 경사면을 위로 하고 바늘을 정맥과 거의 평행하게 하여 바늘을 혈관에 약 2-3mm 밀어 넣습니다. 이 때, 반대쪽 손으로 혈관을 누르고 있던 부위에 힘을 빼서 혈관에 가해지는 압력을 풀어줍니다 (그림 3).
9. 바늘이 정맥에 잘 들어가면 혈액이 역류하여 주사기 내에 혈액이 보일 수도 있으나 항상 보이는 것은 아닙니다 (그림 4).
10. 손가락으로 주사기 피스톤을 밀어 천천히 투여합니다. 바늘이 정맥에 삽입되었으면 저항감 없이 투여가 되며, 정맥이 아닌 곳에 있을 경우 투여 용액이 혈관 주위로 주입되어 피부가 창백해 집니다 (그림 5). 만약 첫번째 시도에 실패하였으면 조금 더 몸통쪽으로 가까운 곳에서 다시 투여를 진행합니다.
11. 정맥에서 바늘을 제거하고 투여 부위를 거즈로 가볍게 눌러서 지혈합니다.
12. 마우스를 cage에 복귀시키고 지혈을 확인하기 위해서 5-10분 동안 동물을 관찰합니다.

그림 2. 미정맥 투여를 위한 보정: Intravenous Tail Vein Injections in the Adult Mouse. 2021.
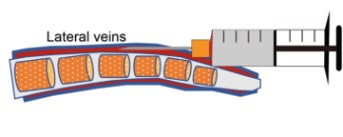
그림 3. 미정맥 투여 모식도: Liu P et al. Methods Mol Biol. 2021;2279:199-212.

그림 4. 바늘이 혈관으로 들어가 피가 역류함. : Intravenous Tail Vein Injections in the Adult Mouse. 2021.

그림 5. 투여실패로 인하여 피부가 창백해짐.: Intravenous Tail Vein Injections in the Adult Mouse. 2021.
[추천하는 바늘, 주사기 및 투여액량]
동물에게 혈액 희석, 고통, 과도한 폐 및 심장에 부담을 주지 않기 위한 최대용량

* 1분 이내 투여가 원칙이며 투여물질이 혈액과 적합성이 있어야 하며, 점성이 높지 않아야 합니다.
** 5-10분정도 투여를 의미하며 투여물질이 자극성이 있을 때 사용합니다. 날개가 달린 주사침을 사용할 수 있습니다.