마우스에서 복대동맥 또는 복대정맥 채혈은 실험종료 단계(Terminal Stage)에서 가능한 채혈법으로 안락사를 실시하기 전, 심마취 상태나 안락사 된 상태에서 실시할 수 있습니다. 마우스의 체중에 따라서 0.4~1.0ml의 채혈이 가능합니다. (안락사 된 상태보다 마취 상태에서 수행할 경우, 혈류로 인해 더 많은 양의 채혈이 가능할 수 있습니다.)
- 재료: 21G-25G needle & 멸균 주사기(1ml), 마취제 (필요시), 수술용 블레이드, 수술용 가위, 수술용 포셋, 채혈 용기 (튜브), 거즈 등
[방법]
1. 심마취된 상태의 마우스를 배(복부)가 위쪽을 향하도록 고정한 뒤, 전체적으로 70% 에탄올을 뿌려 털이 복강 안으로 들어가지 않도록 합니다. 발가락이나 꼬리를 핀셋 등으로 눌러 심마취 상태임을 확인한 후 다음 단계를 수행합니다.
2. 복부의 피부를 Y 또는 V 모양으로 절개한 뒤 복막도 동일하게 혹은 정중앙을 절개합니다.
3. 복강장기(장, 지방 등)를 부드럽게 옆으로 옮기고 간을 앞쪽으로 밀면 양쪽 신장 사이에서 척추를 따라 나란히 주행하는 복대동맥(선홍색, 심장의 박동에 맞춰 혈관의 움직임이 관찰됨) 또는 복대정맥(짙은 적색)을 식별할 수 있습니다. 장을 터뜨리거나 다른 출혈이 발생하지 않도록 주의합니다.
4. 21~25G의 바늘을 가능한 혈관과 평행하게 삽입하여 혈액을 채취합니다. 천천히 syringe를 뒤로 당겨 채혈하며 만약 혈관이 collapse 되면 잠시 멈추고 기다린 뒤 다시 혈액이 차면 syringe를 당겨 채혈합니다. 동맥은 주사바늘 사면이 아래로, 정맥은 주사바늘 사면이 위를 향하게 삽입하며 너무 빠르게 syringe를 당기게 되면 용혈이 일어날 수 있으니 주의합니다.
5. 채혈이 완료되면 동물의 심정지 상태를 확인합니다. (필요시 적절한 방법으로 안락사를 수행합니다.)
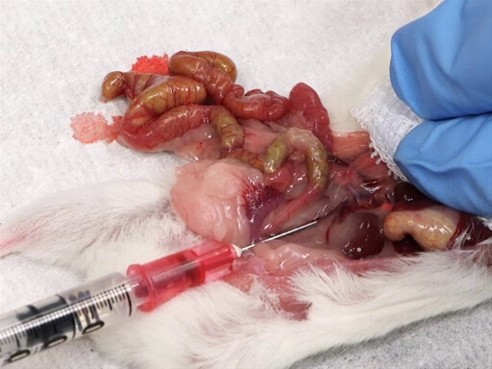
그림 1. Retro orbital blood withdrawal in mice.
* 그림출처: JoVE. Lab Animal Research: Blood WithdrawalⅠ