예쁜꼬마선충의 신경세포는 유형에 따라 감각신경(Sensory Neurons), 연합신경(Interneurons), 운동신경(Motor Neurons)으로 나뉩니다. 예쁜꼬마선충의 움직임은 감각신경이 다양한 환경 요인을 감지하고 이를 연합신경을 통해 하부 경로인 운동신경으로 전달함으로써 결정됩니다. 따라서 세 신경 집단 connection의 조화가 예쁜꼬마선충의 행동을 조절하기 때문에 신경세포의 유형에 따라 표현형들을 구분짓고 예쁜꼬마선충의 행동 변화를 관찰할 수 있습니다.
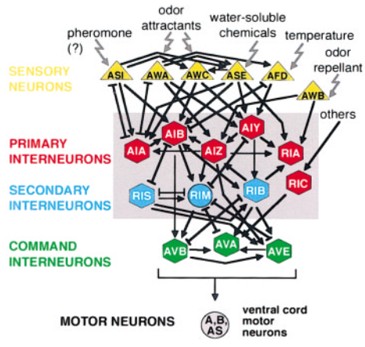
* 그림출처: Tsalik EL et al. J Neurobiol. 2003;56(2):178-197.
1. 감각신경 결함
예쁜꼬마선충의 감각신경의 결함은 먹이와 화합물 탐색 및 인지 실험을 통해 평가할 수 있습니다. 예쁜꼬마선충의 먹이와 화합물 냄새 감지 능력은 chemotaxis assay와 food seeking assay라는 실험을 통해 평가됩니다. Chemotaxis assay와 food seeking assay는 선충이 환경에서 냄새 분자를 탐지하고 이에 반응하여 먹이로 이동하는 능력을 측정하는 방법입니다. 감각신경세포의 결함이 있는 예쁜꼬마선충은 냄새를 인지하지 못하기 때문에 먹이 또는 좋아하는 냄새의 화합물로 이동하지 못하게 됩니다.
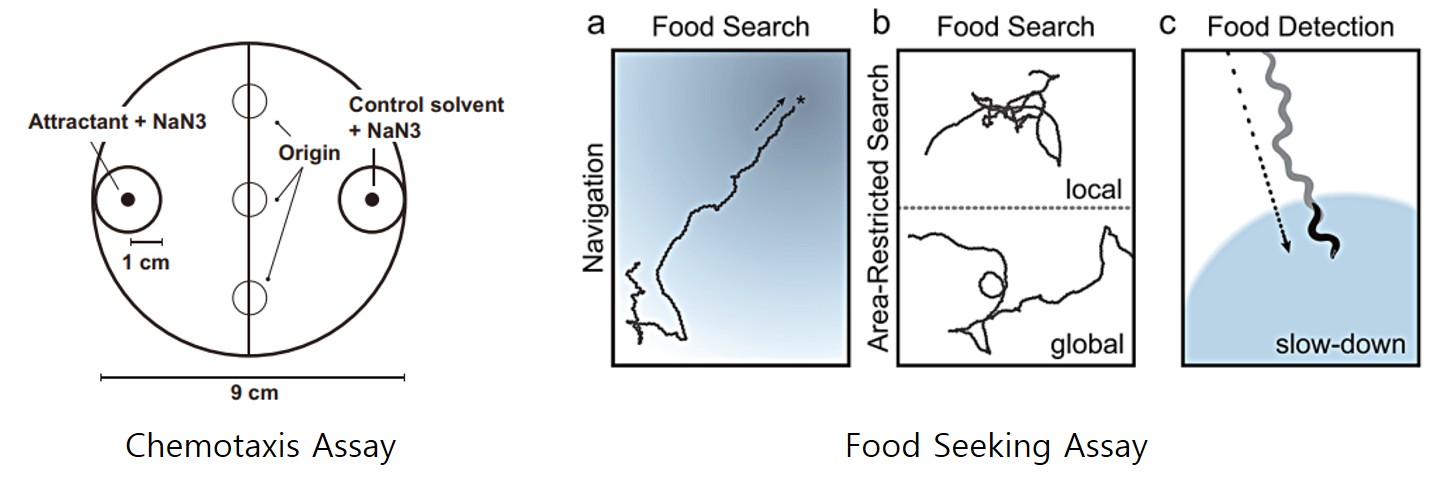
* 그림출처: Suryawinata N et al. Sci Rep. 2024;14(1):5529.
이와 유사하게 예쁜꼬마선충이 먹이를 인지하고 먹이 주변에서 느려지는 행동 변화를 관찰하는 basal slowing assay로도 감각신경세포의 능력을 평가할 수 있습니다. 감각신경세포에 결함이 있는 예쁜꼬마선충은 먹이가 있는 환경을 인지하지 못하고 먹이를 찾기 위한 행동을 지속하게 되면서 운동성이 감소되지 않습니다.
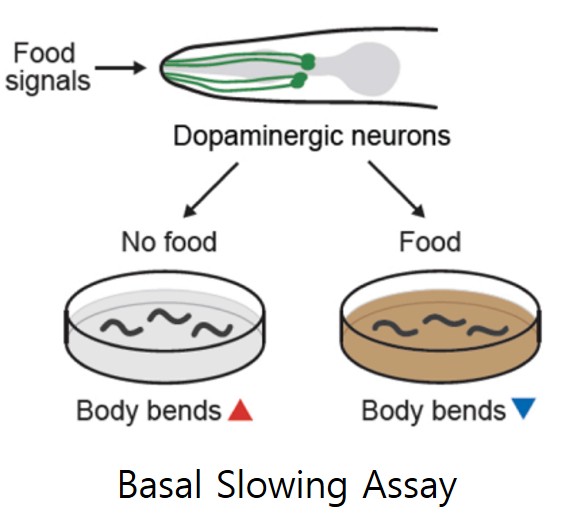
* 그림출처: Lee Y et al. Ecotoxicol Environ Saf. 2023;255:114752.
예쁜꼬마선충은 화합물의 냄새 뿐만 아니라 touch, 압력, 진동과 같은 물리적 힘의 기계감각을 인지하는 신경세포도 보유하고 있습니다. 기계감각 실험은 예쁜꼬마선충이 물리적 자극을 감지하고 이에 반응하는 능력을 평가하는 방법입니다6. 정상적인 선충은 touch 자극에 즉각적으로 반응하여 빠르게 touch 반대 방향으로 이동하는 반면 기계감각 신경 세포가 손상된 선충은 반응을 하지 않고 계속 앞으로 이동합니다. 대표적으로 gentle touch assay와 harsh touch assay가 있으며, 각각에 자극 반응에 관여하는 신경세포의 종류가 다릅니다.
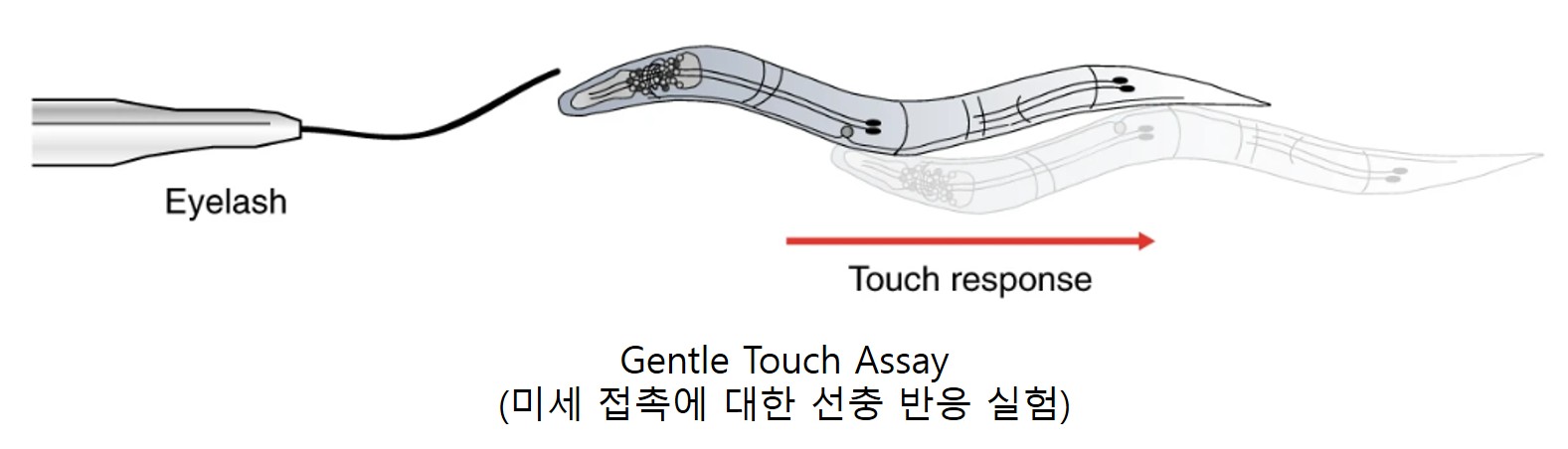
* 그림출처: Koopman M et al. Nat Protoc. 2020;15(6):2071-2106.
2. 운동신경 결함
예쁜꼬마선충의 감각신경세포와 중간신경세포의 신호전달은 최종적으로 운동신경세포에 의해 행동으로 출력됩니다. 운동신경의 결함은 예쁜꼬마선충의 운동성을 제한합니다. 선충의 운동신경세포의 결함을 평가할 수 있는 실험들은 body bending assay, thrashing assay, locomotion assay 등이 있습니다. 예쁜꼬마선충이 고체 배지의 먹이 위에서 움직일 때 S자 형태의 동일한 경로를 보이며 이동하는데, body bending assay는 이 빈도를 측정하여 전반적인 운동성을 평가하는 방법입니다. Thrashing assay는 액체 배지에서 선충의 수영 능력을 평가하는 실험으로 일정 시간을 두고 수영 횟수를 계수하여 운동성을 평가합니다. Locomotion assay는 선충을 고체 배지 위에서 얼마나 멀리 이동하는지를 측정하는 실험입니다. 운동신경의 결함이 있는 예쁜꼬마선충은 움직임의 빈도가 현저히 감소하게 되고, 이동 거리가 줄어드는 등의 비정상적인 표현형을 나타냅니다.
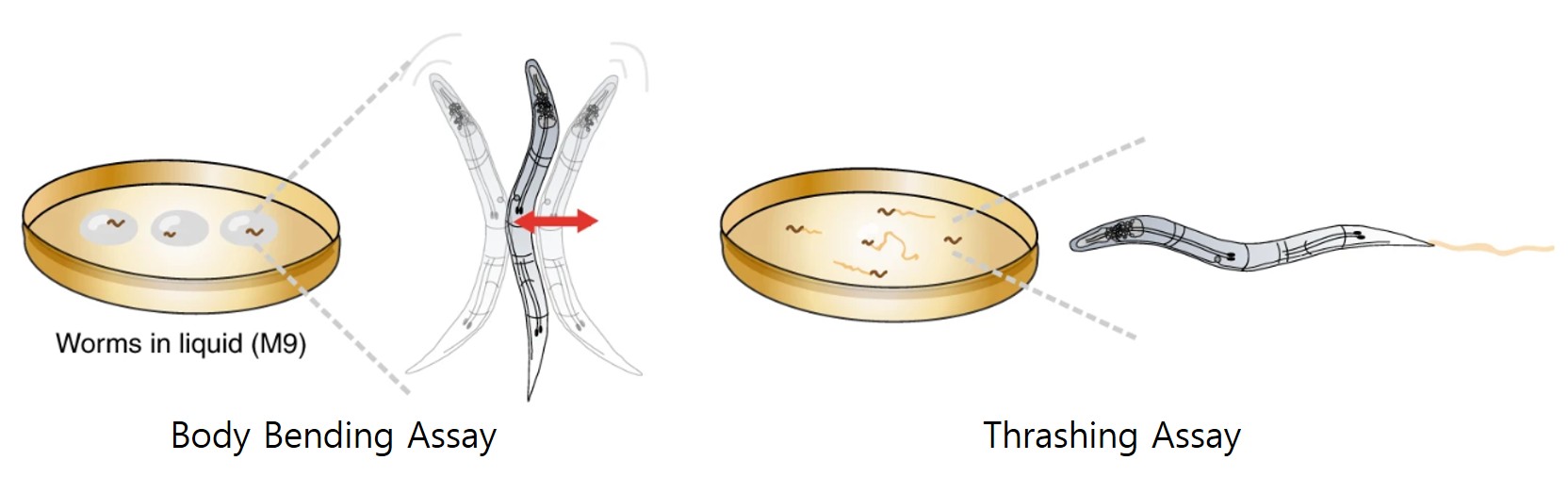
* 그림출처: Koopman M et al. Nat Protoc. 2020;15(6):2071-2106.
예쁜꼬마선충의 신경세포의 결함은 행동 수준에서 뿐만 아니라 세포 수준에서도 평가될 수 있습니다. 다른 동물 모델과 다르게 몸이 투명한 예쁜꼬마선충은 형광 단백질로 감각신경세포 또는 운동신경세포를 표지하여 손상과 퇴행을 현미경을 통해 실시간으로 관찰이 가능합니다. 신경세포의 결함 표현형으로는 대표적으로 신경세포의 신경돌기(축삭돌기 및 수상돌기)가 끊어지거나 신경돌기의 손상, 세포체의 구형화 등이 있습니다. 따라서 신경세포를 관찰하기에 적합한 예쁜꼬마선충은 신경세포의 결함에 따른 행동 표현형의 변화에 대한 직접적인 인과관계를 도출할 수 있습니다.
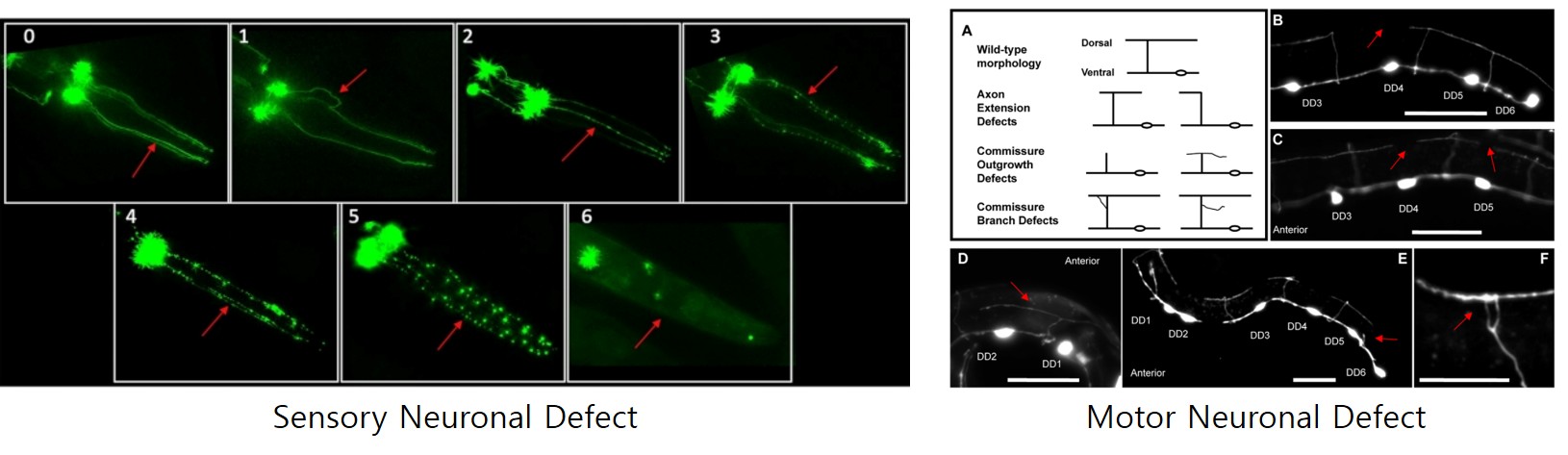
* 그림출처: Bijwadia SR et al. J Vis Exp. 2021;(177):10.3791/62894.