현재 어류 시스템에서 발견되는 감염을 유발하는 원인으로 제브라피시 종에 고유한 P. neurophilia 라는 미포자충문(Microsporidia)에 속하는 포자를 형성하는 단세포 기생충 감염이 있습니다. P. neurophilia 감염은 어류 성체 중추신경계(CNS)에서 흔히 관찰되며, 이 기생충으로 인한 질병은 양성영향부터 쇠약, 골격 기형, 심지어 사망에 이르기까지 광범위한 증상을 나타낼 수 있습니다. 가장 큰 문제는 감염 초기 단계에서 보여주는 증상이 없어 초기대응이 불가능하여 집단 발병을 일으키고 어류 시설에 심각한 위생 문제를 일으킬 수 있으나 감염을 없애기 위한 효과적인 치료법은 아직 개발되지 않았습니다. 따라서 제브라피쉬 시스템의 기생충 감염여부를 초기에 진단할 수 있는 검사법을 구축하는 것이 필요합니다.
기생충에 의한 감염은 배아의 경우 수정 후 12~120 시간 내에 감지가 되기도 하며 성체의 경우 척수, 신경 및 전뇌, 망막상피세포 등의 다양한 조직에서 발견됩니다.
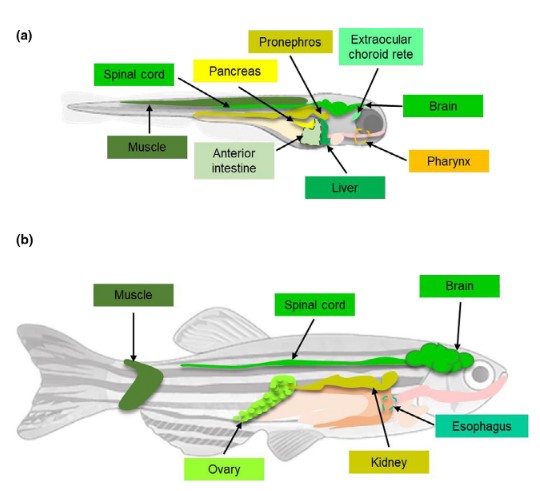
그림 1. 제브라피쉬 배아(a) 및 성체(b)에서 기생충 Pseudoloma neurophilia에 의해 감염되는 조직
* 그림출처: Caballero-Huertas M et al. Rev Aquac. 2021;13:1816-1827.
제브라피쉬의 배아 및 뇌와 척수를 해부하여 Proteinase K 처리 후 PCR을 진행합니다.
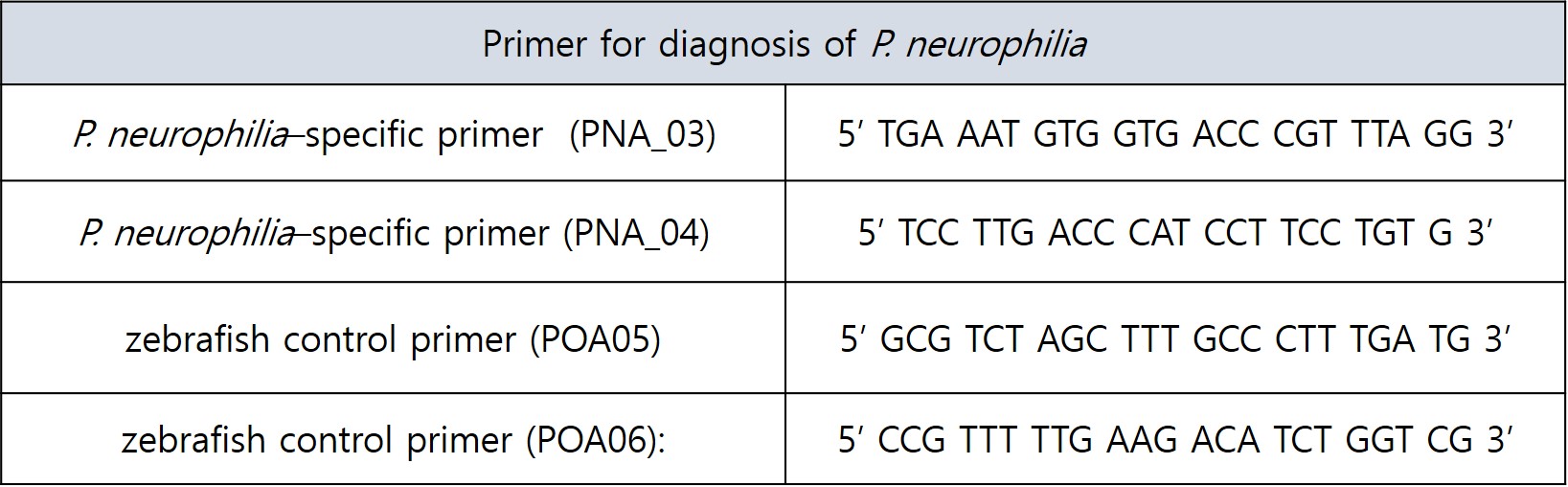
표 1. P. neurophilia 진단을 위한 Primer
P. neurophilia 감염여부를 확인하기 위한 PCR 조건은 아래와 같고 감염이 되었을 경우, PNA의 primer를 사용하였을 경우 441bp의 밴드를 확인할 수 있습니다.
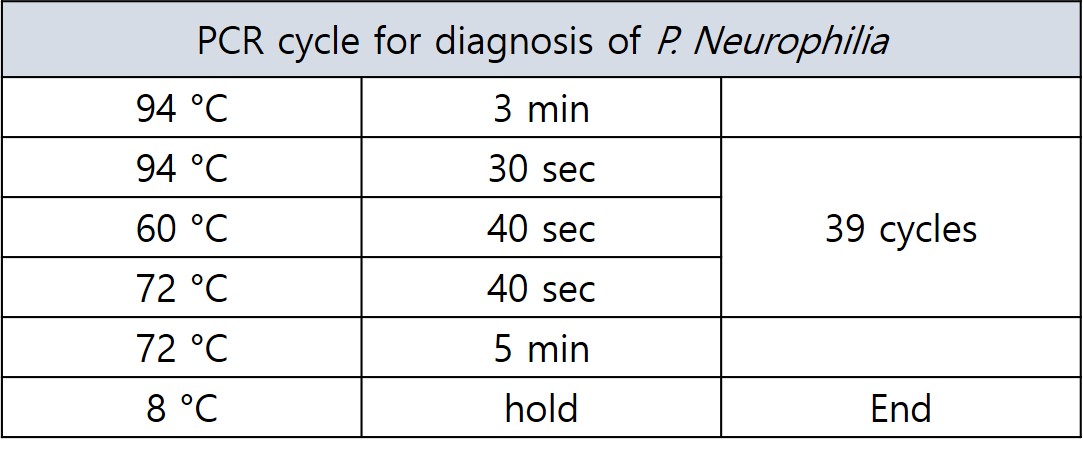
표 2. P. neurophilia 진단을 위한 PCR cycle