Microinjection을 통한 유전자의 조작은 유전자의 역할과 기능을 이해하는데 큰 도움을 줍니다. Microinjection을 하기 위해서는 원하는 DNA를 초파리 알에 넣을 수 있는 기계 및 용액 등을 먼저 준비해야 합니다. Microinjection 기계는 원하는 DNA를 알에 찔러 넣을 수 있는 injection 바늘, 소량의 DNA를 일정하게 나오게 하는 injection pump, 알을 확대해서 볼 수 있는 현미경 등이 필요합니다.

그림 1. Microinjection 기계. (A) Microinjection 용 현미경, (B) Injection 바늘, (C) Injection Pump
초파리 알을 얻기 위해서는 대략 300마리 정도의 성충이 필요합니다. 성충을 egg lay plate가 놓인 embryo collection chamber에 넣고 약 30분간 방치시켜 초파리가 알을 낳도록 유도합니다. 최초로 알을 받은 plate는 embryo injection에 사용하지 않고 버린 후, 새로운 egg lay plate를 교체하여 상온에서(19-24 ºC)에서 30분간 다시 알을 받고 이 알로 injection을 진행해야 합니다. 알을 받는 시간이 30분을 경과하면 embryo의 발생단계가 late stage 2를 지나게 되고, DNA를 주입해야 하는 알의 posterior 방향에 pole cell(생식세포)의 발생도 시작됩니다. Pole cell의 발생이 시작되면 DNA를 알에 제대로 주입시킬 수 없기에 시간을 잘 지켜서 injection을 해야 합니다.
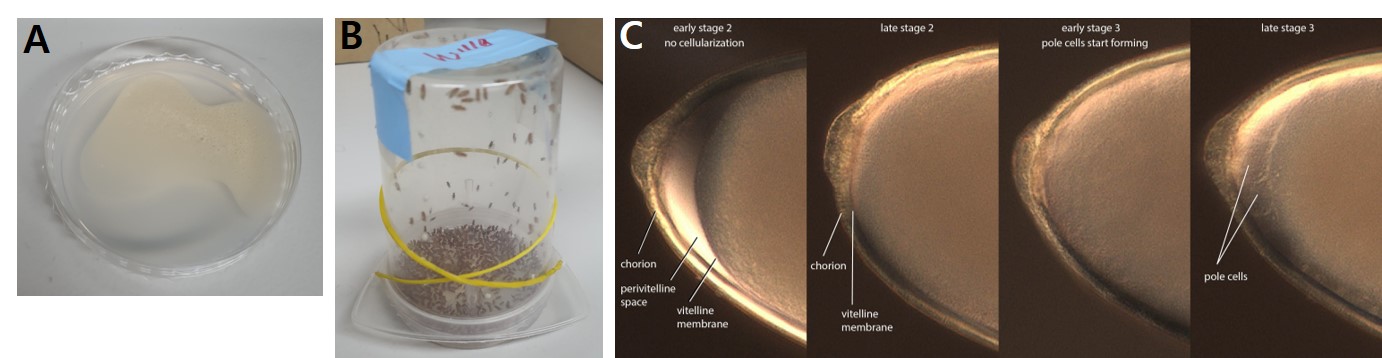
그림 2. (A) Egg Lay Plate, (B) Embryo Collection Chamber, (C) Embryo 발생단계
* 그림출처: Gompel N, Schröder EA. Drosophila germline transformation. 2015. http://gompel.org/wp-content/uploads/2015/12/Drosophila-transformation-with-chorion.pdf
Egg lay plate에 받아진 알을 모아서 멸균수로 씻어준 후 egg의 chorion층을 제거하기 위해서 50% sodium hypochlorite 용액에 egg를 1분 동안 넣어준 후, 다시 멸균수를 이용하여 chorion이 제거된 egg를 씻어줍니다. 양면 테이프를 일정한 크기로 자른 후 Heptane 용액에 24-48시간 담구어 접착성 물질을 녹여낸 용액을 cover glass위에 도말하고 chorion이 제거된 egg를 일정한 방향으로 정렬한 후 상온에서 15-20분간 방치하여 건조 시킵니다. Chorion이 제거된 egg가 과도하게 건조되는 것을 방지하기 위해 Halocarbon oil (oil 700: oil 27 = 3:1)을 건조된 egg에 적당량을 도말하여 줍니다. Egg가 정렬되어 있는 cover glass를 테이프를 이용하여 slide glass 위로 다시 고정시킨 후 microinjection 장비에 고정시킵니다. 그리고 egg의 posterior 부위로 injection을 합니다.

그림 3. Egg 정렬하는 방법
* 그림출처: Gompel N, Schröder EA. Drosophila germline transformation. 2015. http://gompel.org/wp-content/uploads/2015/12/Drosophila-transformation-with-chorion.pdf
Microinjection이 끝난 egg는 cover glass만 떼어내서 일반 배지로 옮겨 준 후 성체 초파리가 깨어날 때까지 24 °C에서 보관하면 됩니다. 깨어난 초파리는 목적에 맞게 스크리닝하여 원하는 초파리를 얻으면 됩니다.
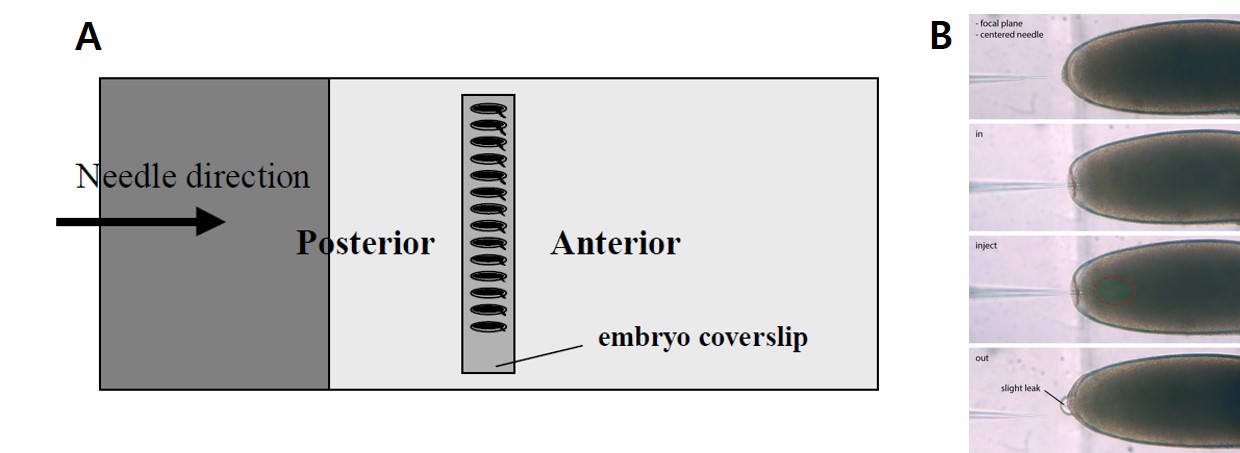
그림 4. Injeciton 부위 및 방법
* 그림출처: (A) Ringrose L. Methods Mol Biol. 2009;561:3-19., (B) Gompel N, Schröder EA. Drosophila germline transformation. 2015. http://gompel.org/wp-content/uploads/2015/12/Drosophila-transformation-with-chorion.pdf