초파리도 뇌가 있습니다. 초파리 유충의 뇌는 성충의 뇌에 비해 작고 먹이를 찾고 기본적인 기능을 조절하는데 집중되어 있습니다. 반면, 성충은 복잡한 행동과 학습 능력을 수행하기 위해 더 크고 복잡한 뇌 구조를 가지고 있습니다. 최근 연구는 초파리 유충에서 3,016개의 뉴런과 54만 8천개의 시냅스를 하나하나 찾아내 분류하여 신경세포(뉴런)와 뉴런의 연결점인 시냅스를 전부 규명한 뇌 지도를 완성하기도 하였습니다.
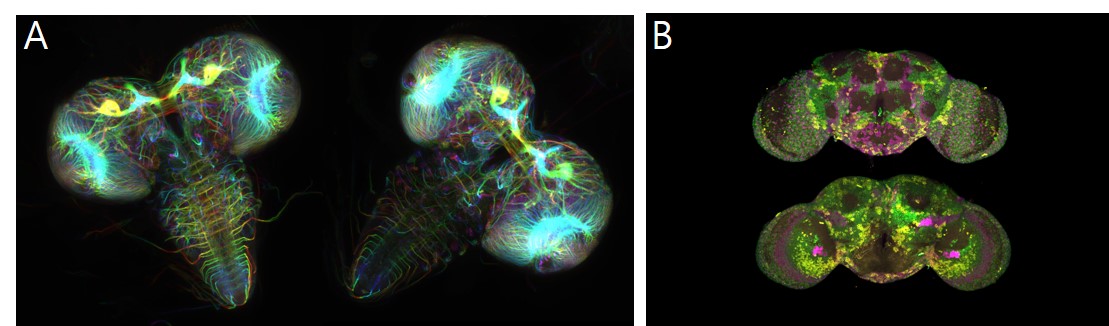
그림 1. 초파리의 유충의 뇌(A)와 성충의 뇌(B)
* 그림출처: (A) Lu W and Gelfand VI. 2018 Photomicrography Competition, Nikon. 2018., (B) Long X, et al. Nat Methods. 2017;14(7):703-706.
초파리도 기억을 할 수 있습니다. 특정 물질을 찾아가거나 2가지 이상의 물질 중에서 한가지를 선택할 때 기존에 학습된 기억에 의존합니다. 특히 초파리는 후각 기억형성에 대해서 연구가 잘 되어 있습니다. 후각 기억형성을 단기기억(short-term memory, STM), 중간기억(intermediate-term memory, ITM), 마취 저항성 기억(anesthesia-resistant memory, ARM) 및 장기기억(long-term memory, LTM)의 4가지 단계로 구분할 수 있습니다. 특정 정보를 인코딩하게 되는 학습(Acquisition, LRN)을 하게 되면 이후 단기기억이 시간이 지남에 따라 장기기억으로 안정화 하거나 망각하는 프로세스를 거치게 됩니다. STM은 훈련 후 높은 학습수준을 유지하다 60분 이내에 사라지는 기억을 말하며 LTM과 ARM은 오래 지속되는 기억을 말합니다. 유전적 해석으로 볼 때 ASM을 STM과 ITM으로 분해할 수 있고, ARM과 LTM을 기능적으로 독립된 기억단계로 분해할 수 있음이 밝혀졌습니다. 또한 LTM은 단백질 합성을 요구하는 반면 ARM은 그렇지 않다는 차이가 있습니다.
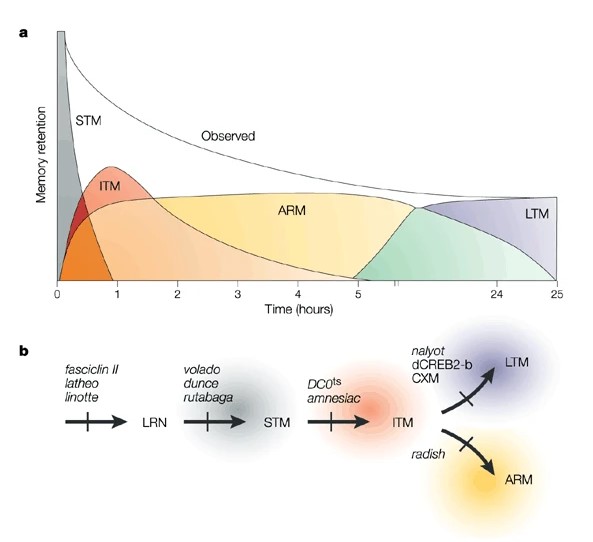
그림 2. 초파리 기억의 일시적인 단계: (a) 기억 저장의 시간적 단계, (b) 특정 유전자 돌연변이로 인해 해당 단계가 중단될 수 있음을 나타냄.
*그림출처: Tully T, et al. Nat Rev Drug Discov. 2003;2(4):267-277.