특정 조직에서만 유전자를 제거하고자 할 때는 조직 특이적 cre 마우스를 이용하면 됩니다.
이 시스템은 cre 효소가 loxP 서열 사이에 있는 DNA를 절제하는 방식으로 작동하며, 특정 조직에서만 cre를 발현하도록 설계된 조직 특이적 cre 마우스를 사용할 수 있습니다. 예를 들어 간에서는 Albumin-cre, T세포에서는 CD4-cre, 근육에서는 ACTA-cre 등을 사용할 수 있습니다. (조직 특이적 cre 마우스 종류 참고: Kim H, Kim M, Im SK, Fang S. Mouse Cre-LoxP system: general principles to determine tissue-specific roles of target genes. Lab Anim Res. 2018;34(4):147-159.)
제거를 원하는 유전자(Gene X)에 loxP site가 삽입된 “floxed mouse”를 간 특이적 cre 발현 마우스(Alb cre)와 교배하면, cre를 가지고 있고 GeneX에 대해 heterozygous floxed 상태인 마우스를 얻을 수 있습니다. 이 마우스를 다시 homozygous floxed mouse와 교배를 시키면 간에서 GeneX가 모두 제거된 실험 마우스를 얻을 수 있습니다.
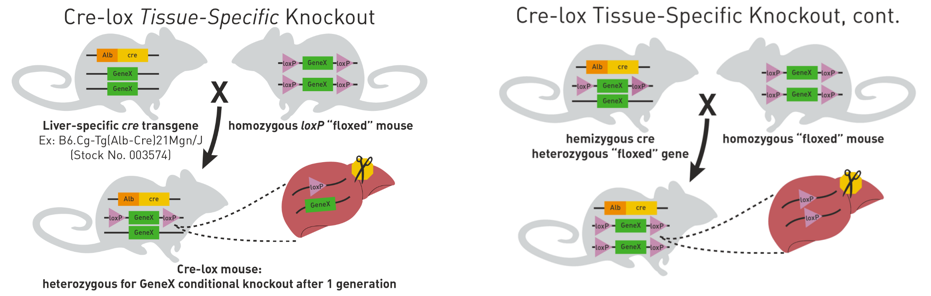
(그림출처) https://www.jax.org/news-and-insights/jax-blog/2011/september/cre-lox-breeding
만약 Cre 발현이 실제로 조직 특이적으로 잘 작동되는지 확인하려면 reporter 마우스 (Rosa26-LSL-tdTomato, Rosa26-LSL-EYFP, ROSA26-LacZ reporter 등)와 교배해 형광 단백질 발현을 통해 확인 할 수 있습니다.
Reporter 마우스를 Cre 마우스와 교배하면, Cre가 발현된 조직에서만 loxP 사이의 STOP cassette이 제거되어 형광 단백질(예: tdTomato, EYFP)이나 β-galactosidase(LacZ)가 발현됩니다. 형광 단백질 발현은 형광현미경 관찰을 통해 확인하거나 β-galactosidase를 염색해서 조직학적으로 확인할 수 있습니다.
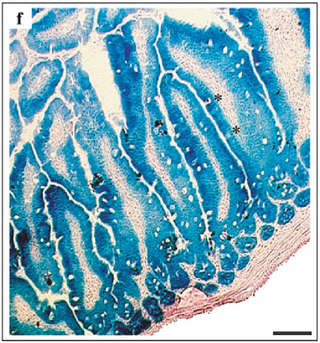
* 그림: 장 상피에서 Villin cre 발현여부를 X-gal 염색으로 확인 (X-gal 염색: β-galactosidase와 반응하여 푸른색을 띠는 염색약)
(그림출처) el Marjou F, Janssen KP, Chang BH, et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. Genesis. 2004;39(3):186-193.